For Living More⚕️
🚑 Εφημερεύοντα φαρμακεία / Τηλέφωνα Α’ Ανάγκης 🚑
Βρες τις χαμηλότερες τιμές φαρμάκων 💊
Μια σύντομη γνωριμία με τη γονιδιακή θεραπεία
![]() 18-10-2020
18-10-2020
![]()
![]()
![]()



Φανταστείτε ότι έχετε μια διαρροή νερού στο σπίτι σας. Θα μπορούσε να σκεφτεί κανείς διάφορες λύσεις στο πρόβλημά σας. Μία λύση θα ήταν να χρησιμοποιήσετε έναν κουβά και να απομακρύνετε επαναλαμβανόμενα το νερό. Όπως γίνεται αντιληπτό αυτή η λύση είναι επίπονη, δαπανηρή και μάταιη, καθώς δε θα διορθώσετε ουσιαστικά το πρόβλημα. Μία πιο αναμενόμενη εναλλακτική, λοιπόν, θα ήταν να εντοπίσετε τη βλάβη στις σωληνώσεις και να την επιδιορθώσετε. Κάπως έτσι φανταστείτε ότι λειτουργεί η γονιδιακή θεραπεία, μόνο που στην περίπτωσή μας το πρόβλημα δεν είναι μια διαρροή νερού, αλλά μια ανθρώπινη γενετική ασθένεια.
Τι είναι η γονιδιακή θεραπεία;
Σκοπός της παραπάνω αναλογίας είναι να αποκαλύψει τον πρωταρχικό στόχο της γονιδιακής θεραπείας που είναι ο εντοπισμός και η επιδιόρθωση της αιτίας στην οποία οφείλεται μια ανθρώπινη γενετική ασθένεια, και όχι απλά η αντιμετώπιση των συμπτωμάτων στην οποία στοχεύουν οι συμβατικές φαρμακευτικές αγωγές. Αυτή η αιτία συνήθως είναι ένα ή περισσότερα ελαττωματικά γονίδια. Ως γονιδιακή θεραπεία θα μπορούσαμε να ορίσουμε τη χρήση DNA ή RNA για τη θεραπεία ή την πρόληψη μιας ανθρώπινης ασθένειας.
Μια προσέγγιση, στην οποία θα εστιαστούμε στο παρόν άρθρο, αποτελεί η μεταφορά των φυσιολογικών αντιγράφων των γονιδίων στα κύτταρα του ασθενούς, η έκφραση των οποίων υποκαθιστά ή εξαλείφει τη δράση των ελαττωματικών αντιγράφων. Τα τελευταία χρόνια, όμως, παρατηρείται ραγδαία πρόοδος και στην άμεση τροποποίηση του γενετικού υλικού με τη βοήθεια νουκλεασών.
Ενώ θεωρητικά η ιδέα της γονιδιακής θεραπείας μπορεί να φαίνεται απλή, κατά την εφαρμογή της παρουσιάζονται μεγάλες δυσκολίες και προκλήσεις.
Πώς πραγματοποιείται η μεταφορά των γονιδίων;
Δεδομένης της δυσκολίας ενσωμάτωσης εξωγενούς DNA σε ανθρώπινα κύτταρα, κρίσιμη θεωρήθηκε η εύρεση ενός τρόπου μεταφοράς των θεραπευτικών γονιδίων στο εσωτερικό των κυττάρων. Ως οχήματα μεταφοράς γονιδίων φάνηκαν να λειτουργούν αρκετά αποτελεσματικά οι γενετικά τροποποιημένοι ιοί. Οι ιοί, αυτοί, μεταφέρουν τα επιθυμητά γονίδια στο εσωτερικό των ανθρώπινων κυττάρων, ενώ παράλληλα έχουν αδρανοποιηθεί έτσι ώστε να μην εμφανίζουν παθογόνο δράση.
Εκτός από τους ιικούς φορείς, για τη μεταφορά γονιδίων έχουν χρησιμοποιηθεί και μη ιικές φυσικοχημικές στρατηγικές, στις οποίες γυμνό DNA μεταφέρεται απευθείας σε κύτταρα. Σε αυτές περιλαμβάνονται η μεταφορά μέσω χημικής υποβοήθησης, η χρήση νανοσωματιδίων και διάφορες άλλες τεχνικές. Ενώ οι προσεγγίσεις, αυτές, επιδεικνύουν απλότητα στη χρήση και προκαλούν μειωμένο προβληματισμό όσον αφορά ζητήματα βιοασφάλειας, υστερούν στην απόδοση της γονιδιακής μεταφοράς. Συγκεκριμένα, τα επίπεδα γονιδιακής έκφρασης παρουσιάζονται χαμηλότερα σε σύγκριση με αυτά των ιικών συστημάτων μεταφοράς, ενώ η έκφραση είναι παροδική.
Σημαντικό είναι να διευκρινιστεί ότι η μεταφορά των γονιδίων δύναται να πραγματοποιηθεί είτε εφόσον έχει προηγηθεί απομάκρυνση των κύτταρων από το σώμα του ασθενούς, όπου μετά τη μεταφορά θα ακολουθήσει μεταμόσχευση των εμπλουτισμένων με τα θεραπευτικά γονίδια κυττάρων και πάλι πίσω στον ασθενή ( ex vivo γονιδιακή θεραπεία), είτε χωρίς την απομόνωση των κυττάρων, αλλά απευθείας στα κύτταρα του σώματος του ασθενούς (in vivo γονιδιακή θεραπεία).
Ποιοι ιοί μπορούν να χρησιμοποιηθούν ως φορείς;
Ως οχήματα μεταφοράς γονιδίων έχουν χρησιμοποιηθεί τόσο ιοί που έχουν DNA, όσο και ιοί που έχουν RNA ως γενετικό υλικό (είτε μονόκλωνο είτε δίκλωνο).
Σε ένα μεγάλο αριθμό μελετών παρατηρείται η χρήση ρετροϊών ως μέσο μεταφοράς. Οι ρετροϊοί έχουν RNA ως γενετικό υλικό και μπορούν να ενσωματώσουν μέχρι και 8 kb ξένου γενετικού υλικού. Αφού ενσωματωθούν τα επιθυμητά γονίδια στον ιό και εφόσον ο ιός αδρανοποιηθεί, το RNA του μεταφέρεται στο εσωτερικό των ανθρώπινων κυττάρων όπου λαμβάνει χώρα η αντίστροφη μεταγραφή, δηλαδή η μετατροπή του RNA σε DNA. Έπειτα ακολουθεί ενσωμάτωση στο γονιδίωμα του κυττάρου και μακροπρόθεσμη έκφραση των γονιδίων με απώτερο σκοπό την πλήρη ή μερική αναστροφή των συμπτωμάτων της γενετικής ασθένειας. Η ενσωμάτωση των ρετροϊών στο ανθρώπινο γονιδίωμα γίνεται με τυχαίο τρόπο, γεγονός που σε ορισμένες περιπτώσεις έχει οδηγήσει σε φαινόμενα τοξικότητας. Ως εκ τούτου έχουν γίνει προσπάθειες ανάπτυξης ασφαλέστερων φορέων, των οποίων η ενσωμάτωση είναι πιο στοχευμένη.
Ελάττωση στη χρήση των ρετροϊών παρατηρήθηκε όταν ανακαλύφθηκαν οι λεντοϊοί ως δυνητικοί φορείς των θεραπευτικών γονιδίων. Οι λεντοϊοί είναι ρετροϊοί με δυνατότητα ενσωμάτωσης μεγάλων κομματιών γενετικού υλικού και παρουσιάζουν πιο ευνοϊκό προφίλ ενσωμάτωσης. Οι λεντοϊοί, σε αντίθεση με άλλους ιούς, προσβάλλουν, πέρα από διαιρούμενα, και μη διαιρούμενα κύτταρα, ενώ τείνουν να ενσωματώνονται σε κωδικές περιοχές του ανθρώπινου γονιδιώματος και όχι σε ρυθμιστικές, με αποτέλεσμα μειωμένη πιθανότητα τοξικότητας.
Οι αδενοϊοί αποτελούν τους πιο ευρέως χρησιμοποιούμενους φορείς. Περιέχουν δίκλωνο DNA και έχουν τη δυνατότητα ενσωμάτωσης μέχρι 7,5 kb γενετικού υλικού. Οι αδενοϊοί παρουσιάζουν υψηλή απόδοση όσον αφορά τη μεταγωγή, υψηλά επίπεδα γονιδιακής έκφρασης (παροδικής ωστόσο) και έχουν την ικανότητα μόλυνσης μη διαιρούμενων κυττάρων. Οι αρχικοί φορείς που χρησιμοποιήθηκαν προκαλούσαν σφοδρές ανοσολογικές αντιδράσεις, ωστόσο ύστερα από γενετικές τροποποιήσεις επιτεύχθηκε μειωμένη ανοσογονικότητα.
Ένας συγγενικός ιός, ο αδενοσχετιζόμενος ιός (AAV), χρησιμοποιείται επίσης συχνά σε μελέτες γονιδιακής θεραπείας. Ο ιός, αυτός, αποτελείται από μικρό μονόκλωνο RNA, παρουσιάζει χαμηλή παθογονικότητα και τοξικότητα και το γενετικό του υλικό δεν ενσωματώνεται στο γονιδίωμα του ανθρώπινου κυττάρου, αλλά σχηματίζει κυκλικό επίσωμα. Στην περίπτωση που χρησιμοποιείται ο AAV ως φορέας κρίνεται απαραίτητη η εφαρμογή της γονιδιακής θεραπείας επαναλαμβανόμενα.
Άλλοι ιοί που έχουν χρησιμοποιηθεί ως φορείς είναι φλαβοϊοί, ο ιός της ευλογιάς, ο ιός της δαμαλίτιδας και όχι μόνο. Αυτό που πρέπει να τονιστεί είναι πως δεν υπάρχει ένας ιός κατάλληλος για όλες τις περιπτώσεις. Η επιλογή του ιού εξαρτάται από το επιθυμητό επίπεδο έκφρασης του θεραπευτικού παράγοντα, την επιθυμητή διάρκεια, καθώς και τις προσωπικές προτιμήσεις του εκάστοτε ερευνητή/γιατρού.



Εικόνα 1: Ιικοί φορείς που έχουν χρησιμοποιηθεί για τη μεταφορά θεραπευτικών γονιδίων.
Ποιες ασθένειες αποτελούν στόχοι της γονιδιακής θεραπείας;
Απαραίτητη προϋπόθεση για να εφαρμοστεί η γονιδιακή θεραπεία είναι να έχει ταυτοποιηθεί το γονίδιο ή τα γονίδια που είναι υπεύθυνα για την εκάστοτε νόσο, αλλά και να έχουν κλωνοποιηθεί. Καίριας σημασίας είναι, επίσης, η εύκολη προσβασιμότητα των κυττάρων.
Παρόλο που οι αρχικές μελέτες ήταν περιορισμένες σε μονογονιδιακές ασθένειες, μεταγενέστερα παρατηρήθηκε μια διεύρυνση του φάσματος των γενετικών ασθενειών που αποτέλεσαν στόχοι της γονιδιακής θεραπείας. Όπως φαίνεται και στην εικόνα 2, ο καρκίνος αποτελεί τον κυριότερο στόχο της γονιδιακής θεραπείας. Στη συνέχεια ακολουθούν με χαμηλότερα ποσοστά μονογονιδιακές ασθένειες, λοιμώδεις ασθένειες, καρδιαγγειακές νόσοι και διάφοροι άλλοι τύποι ασθενειών.
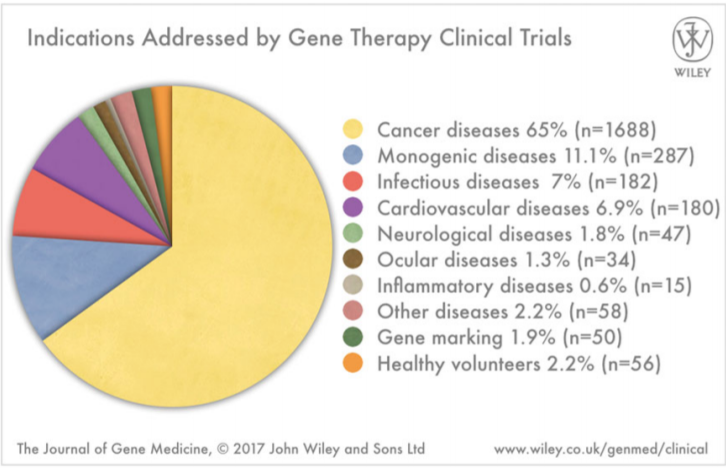


Εικόνα 2: Τύποι ασθενειών που αποτέλεσαν στόχοι κλινικών δοκιμών γονιδιακής θεραπείας.
Ποιες προκλήσεις προέκυψαν κατά την εφαρμογή της γονιδιακής θεραπείας;
Μπορεί η γονιδιακή θεραπεία να φαντάζει στο μυαλό μας πανάκεια για την αντιμετώπιση της πλειοψηφίας των ανθρώπινων ασθενειών, ωστόσο δεν είναι λίγες οι φορές που αμφισβητήθηκε η αποτελεσματικότητα και η ασφάλεια αυτού του είδους θεραπείας.
Έπειτα από την πρώτη επιτυχημένη κλινική δοκιμή γονιδιακής θεραπείας το 1990, η οποία αφορούσε τη θεραπεία της βαριάς συνδυασμένης ανοσοανεπάρκειας (SCID), ακολούθησαν χιλιάδες ακόμα δοκιμές γονιδιακής θεραπείας μέσα στη δεκαετία του 90. Πολλές από αυτές τις δοκιμές κατέληξαν να είναι ανεπιτυχείς λόγω της υπέρμετρης αισιοδοξίας των ερευνητών, η οποία κρίθηκε αδικαιολόγητη σύμφωνα με τα Εθνικά Ινστιτούτα Υγείας (NIH) δεδομένης της έλλειψης βασικών γνώσεων που αφορούσαν τους ιούς , τα κύτταρα, τους ιστούς αλλά και τις διάφορες γενετικές ασθένειες.
Η μεταφορά των γονιδίων φάνηκε από τις αρχικές, ακόμα, μελέτες, ότι θα είναι η Αχίλλειος πτέρνα της γονιδιακής θεραπείας. Μεγάλος αριθμός επιπλοκών παρουσιάστηκε κατά τη προσπάθεια χρήσης ιικών φορέων για τη μεταφορά των γονιδίων. Οι επιπλοκές αφορούσαν την εμφάνιση ανεπιθύμητων ανοσολογικών αντιδράσεων, όπως στην περίπτωση του Jesse Gelsinger, ο οποίος κατέληξε λόγω έντονων ανοσολογικών αντιδράσεων κατά την προσπάθεια αντιμετώπισης της ανεπάρκειας της τρανσκαρβαμυλάσης της ορνιθίνης (OTC) ,από την οποία έπασχε, με τη βοήθεια της γονιδιακής θεραπείας. Εκτός από τις ανοσολογικές αντιδράσεις, σημαντικό πρόβλημα αποτέλεσε και η πιθανή τοξικότητα των ιικών φορέων.
Ύστερα από εντατική έρευνα και προσπάθειες για ανάπτυξη αξιόπιστων φορέων ακολούθησε μια δεύτερη γενιά πειραμάτων στις αρχές του 2000. Ενώ επιτυχημένες κλινικές δοκιμές έδωσαν σημάδια σημαντικού κλινικού οφέλους της γονιδιακής θεραπείας, τροχοπέδη στη ραγδαία πρόοδο και στην καθιέρωση της εφαρμογής της γονιδιακής θεραπείας αποτέλεσαν και πάλι η ανοσογονικότητα και η τοξικότητα των φορέων, οι οποίες επιβράδυναν την εξέλιξη της γονιδιακής θεραπείας.
Τα τελευταία 10 χρόνια οι διεξοδικές μελέτες για την κατανόηση του μηχανισμού της γονιδιακής θεραπείας, οι τροποποιήσεις που σχετίζονται με την ασφάλεια αυτού του είδους θεραπείας, καθώς και οι προσπάθειες για πιο αποδοτική μεταφορά και ενσωμάτωση των θεραπευτικών γονιδίων οδήγησαν σε επιτυχημένες εφαρμογές της θεραπείας που συνέβαλαν στην ουσιαστική κλινική πρόοδο της. Ενθαρρυντικά φαίνονται τα αποτελέσματα που αφορούν πολλαπλές ασθένειες, συμπεριλαμβανομένης της β-θαλασσαιμίας, της μεταχρωματικής λευκοδυστροφίας, του συνδρόμου Wiskott–Aldrich και της συγγενούς αμαύρωσης Leber. Ανάμεσα σε πολλά αξιοσημείωτα αποτελέσματα μελετών ορόσημο αποτελεί το Glybera, το πρώτο εμπορικά διαθέσιμο προϊόν γονιδιακής θεραπείας. Το Glybera εγκρίθηκε το 2012 από την Ευρωπαϊκή Επιτροπή Φαρμάκων και στοχεύει στη θεραπεία της ανεπάρκειας της λιποπρωτεϊνικής λιπάσης (LPLD). Επίσης, αρκετά γονιδιακά προϊόντα έχουν εγκριθεί από τον Οργανισμό Τροφίμων και Φαρμάκων (FDA). Ένα από αυτά είναι η γονιδιακή θεραπεία Luxturna που στοχεύει στη θεραπεία ασθενών που πάσχουν από κληρονομική απώλεια όρασης που μπορεί να οδηγήσει σε τύφλωση, αλλά και το προϊόν Zolgensma για τη θεραπεία παιδιών σε ηλικία μικρότερη των 2 χρόνων που πάσχουν από Νωτιαία Μυϊκή Ατροφία (SMA).
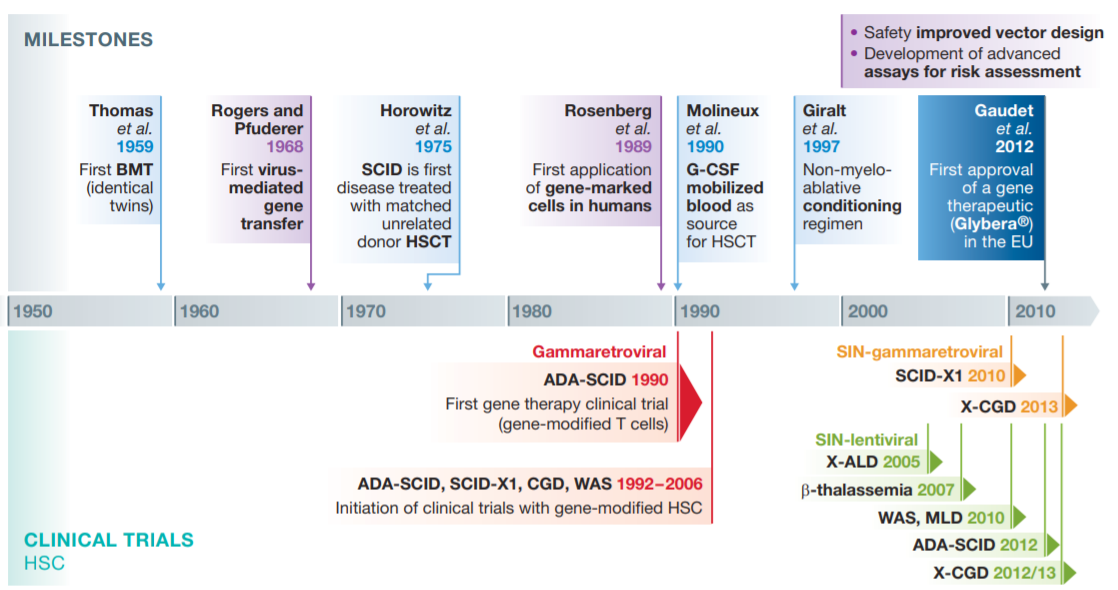


Εικόνα 3: Χρονοδιάγραμμα κλινικών δοκιμών γονιδιακής θεραπείας που βασίστηκαν στη χρήση αιμοποιητικών βλαστικών κυττάρων.
Ποια ηθικά ζητήματα σχετίζονται με τη γονιδιακή θεραπεία;
Παράλληλα με την πρόοδο της γονιδιακής θεραπείας έχουν σημειωθεί έντονες αντιπαραθέσεις που άπτονται ηθικών ζητημάτων . Ένα ζήτημα που εγείρει αντιδράσεις είναι η γονιδιακή θεραπεία γαμετικής σειράς, η οποία επηρεάζει όχι μόνο το θεραπευόμενο άτομο, αλλά και τους απογόνους του, οι οποίοι προφανώς δεν έχουν δώσει τη συγκατάθεσή τους. Επίσης, κοινωνική ανησυχία προκαλεί το γεγονός ότι η ενισχυτική γονιδιακή θεραπεία, η οποία στοχεύει στην ενίσχυση κάποιων επιθυμητών χαρακτηριστικών και όχι στη θεραπεία κάποιας ασθένειας, θα μπορούσε να είναι ένα πιθανό επόμενο βήμα εξέλιξης της γονιδιακής θεραπείας. Τέλος, πολυάριθμες συζητήσεις αφορούν το κόστος της γονιδιακής θεραπείας, την ασφαλιστική κάλυψη αλλά και το αν συντρέχει λόγος να διενεργηθεί η γονιδιακή θεραπεία σε όλες τις περιπτώσεις.
Φτάνοντας στο τέλος, η γονιδιακή θεραπεία έχει σημειώσει αλματώδη πρόοδο τα τελευταία χρόνια και φαίνεται να αποτελεί ένα ρηξικέλευθο και ενθαρρυντικό βήμα για την αντιμετώπιση πληθώρας γενετικών ασθενειών. Ωστόσο ο δρόμος για την ενσωμάτωση αυτού του είδους θεραπείας στο ¨οπλοστάσιο¨ της συμβατικής Ιατρικής και στις κλινικές εφαρμογές ρουτίνας είναι μακρύς και δύσβατος. Χρειάζονται συνεχείς μελέτες και κλινικές δοκιμές για την εξασφάλιση ζητημάτων αποτελεσματικότητας και ασφάλειας, ενώ επιτακτική είναι η ανάγκη για τη σύνταξη νομικών διατάξεων και κανόνων δεοντολογίας από διεθνείς επιτροπές με γνώμονα το ευρύτερο κοινωνικό συμφέρον.
Βιβλιογραφικές αναφορές
- Samantha L. Ginn, Anais K. Anaya, Ian E. Alexander, Michael Edelstein, Mohammad R. Abedi, ¨Gene therapy clinical trials worldwide to 2017: An update¨, J Gene Med 20, 3015 (2018)
- Cynthia E. Dunbar, Katherine A. High, J. Keith Joung, Donald B. Kohn, Keiya Ozawa, Michel Sadelain, ¨ Gene therapy comes of age¨, Science 359, 175 (2018)
- Kerstin B. Kaufmann, Hildegard Büning, Anne Galy, Axel Schambach, Manuel Grez,¨Gene therapy on the move ¨, EMBO Mol Med 5, 1642-1661 (2013)
- Kenneth Lundstrom, ¨Viral Vectors in Gene Therapy¨, Diseases 6, 42 (2018)
- William S. Klug, Michael R. Cummings, Charlotte A. Spencer, Michael A. Palladino, Darrell Killian, ¨Βασικές αρχές Γενετικής¨, Ακαδημαϊκές Εκδόσεις, 925-943, 2019
- Peter J. Russell, ¨iGenetics.Μια Μεντελική προσέγγιση¨, Ακαδημαϊκές Εκδόσεις, 2009-2013
- https://www.fda.gov/consumers/consumer-updates/what-gene-therapy-how-does-it-work
- https://www.fda.gov/news-events/press-announcements/fda-approves-novel-gene-therapy-treat-patients-rare-form-inherited-vision-loss
- https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease
Εικόνες
Εικόνα 1: Samantha L. Ginn, Anais K. Anaya, Ian E. Alexander, Michael Edelstein, Mohammad R. Abedi, ¨Gene therapy clinical trials worldwide to 2017: An update¨, J Gene Med 20, 3015 (2018)
Εικόνα 2: Samantha L. Ginn, Anais K. Anaya, Ian E. Alexander, Michael Edelstein, Mohammad R. Abedi, ¨Gene therapy clinical trials worldwide to 2017: An update¨, J Gene Med 20, 3015 (2018)
Εικόνα 3: Kerstin B. Kaufmann, Hildegard Büning, Anne Galy, Axel Schambach, Manuel Grez, ¨Gene therapy on the move ¨, EMBO Mol Med 5, 1642-1661 (2013)
Truemed-ForLivingMore
Κοινοποιήστε








14ο Πανελλήνιο Συνέδριο Φοιτητών Νοσηλευτικής
Οι φοιτητές του Τμήματος Νοσηλευτικής του Εθνικού και Καποδιστριακού Πανεπιστημίου Αθηνών, σας καλωσορίζουν στο 14ο ΠΣΦΝ, που θα πραγματοποιηθεί 19-21 Απριλίου του 2024.

Νόσος Graves: Σύγχρονη και Οριστική Θεραπεία του Υπερθυρεοειδισμού!
Η νόσος Graves έχει αναδειχθεί η πιο συχνή αιτία του υπερθυρεοειδισμού σε παγκόσμια κλίμακα, ενώ συνιστά ένα αυτοάνοσο νόσημα που αφορά στον θυρεοειδή αδένα.
ΡΟΗ ΕΙΔΗΣΕΩΝ
| Επικοινωνία | Η ομάδα μας | Διαφημιστείτε στη truemed.gr| | Όροι χρήσης | Προσωπικά δεδομένα | Copyright©Truemed | |Για περισσότερη ζωή | Υγειά-διατροφή |
Designed – Developed by Premiumweb.gr
ΒΡΕΙΤΕ ΜΑΣ ![]()
![]()


© 2019 TrueMed Media. All rights reserved. Our website services, content, and products are for informational purposes only. TrueMed Media does not provide medical advice, diagnosis, or treatment.
Μια σύντομη γνωριμία με τη γονιδιακή θεραπεία
![]()
![]()
![]()
![]()
![]()
![]()



Φανταστείτε ότι έχετε μια διαρροή νερού στο σπίτι σας. Θα μπορούσε να σκεφτεί κανείς διάφορες λύσεις στο πρόβλημά σας. Μία λύση θα ήταν να χρησιμοποιήσετε έναν κουβά και να απομακρύνετε επαναλαμβανόμενα το νερό. Όπως γίνεται αντιληπτό αυτή η λύση είναι επίπονη, δαπανηρή και μάταιη, καθώς δε θα διορθώσετε ουσιαστικά το πρόβλημα. Μία πιο αναμενόμενη εναλλακτική, λοιπόν, θα ήταν να εντοπίσετε τη βλάβη στις σωληνώσεις και να την επιδιορθώσετε. Κάπως έτσι φανταστείτε ότι λειτουργεί η γονιδιακή θεραπεία, μόνο που στην περίπτωσή μας το πρόβλημα δεν είναι μια διαρροή νερού, αλλά μια ανθρώπινη γενετική ασθένεια.
Τι είναι η γονιδιακή θεραπεία;
Σκοπός της παραπάνω αναλογίας είναι να αποκαλύψει τον πρωταρχικό στόχο της γονιδιακής θεραπείας που είναι ο εντοπισμός και η επιδιόρθωση της αιτίας στην οποία οφείλεται μια ανθρώπινη γενετική ασθένεια, και όχι απλά η αντιμετώπιση των συμπτωμάτων στην οποία στοχεύουν οι συμβατικές φαρμακευτικές αγωγές. Αυτή η αιτία συνήθως είναι ένα ή περισσότερα ελαττωματικά γονίδια. Ως γονιδιακή θεραπεία θα μπορούσαμε να ορίσουμε τη χρήση DNA ή RNA για τη θεραπεία ή την πρόληψη μιας ανθρώπινης ασθένειας.
Μια προσέγγιση, στην οποία θα εστιαστούμε στο παρόν άρθρο, αποτελεί η μεταφορά των φυσιολογικών αντιγράφων των γονιδίων στα κύτταρα του ασθενούς, η έκφραση των οποίων υποκαθιστά ή εξαλείφει τη δράση των ελαττωματικών αντιγράφων. Τα τελευταία χρόνια, όμως, παρατηρείται ραγδαία πρόοδος και στην άμεση τροποποίηση του γενετικού υλικού με τη βοήθεια νουκλεασών.
Ενώ θεωρητικά η ιδέα της γονιδιακής θεραπείας μπορεί να φαίνεται απλή, κατά την εφαρμογή της παρουσιάζονται μεγάλες δυσκολίες και προκλήσεις.
Πώς πραγματοποιείται η μεταφορά των γονιδίων;
Δεδομένης της δυσκολίας ενσωμάτωσης εξωγενούς DNA σε ανθρώπινα κύτταρα, κρίσιμη θεωρήθηκε η εύρεση ενός τρόπου μεταφοράς των θεραπευτικών γονιδίων στο εσωτερικό των κυττάρων. Ως οχήματα μεταφοράς γονιδίων φάνηκαν να λειτουργούν αρκετά αποτελεσματικά οι γενετικά τροποποιημένοι ιοί. Οι ιοί, αυτοί, μεταφέρουν τα επιθυμητά γονίδια στο εσωτερικό των ανθρώπινων κυττάρων, ενώ παράλληλα έχουν αδρανοποιηθεί έτσι ώστε να μην εμφανίζουν παθογόνο δράση.
Εκτός από τους ιικούς φορείς, για τη μεταφορά γονιδίων έχουν χρησιμοποιηθεί και μη ιικές φυσικοχημικές στρατηγικές, στις οποίες γυμνό DNA μεταφέρεται απευθείας σε κύτταρα. Σε αυτές περιλαμβάνονται η μεταφορά μέσω χημικής υποβοήθησης, η χρήση νανοσωματιδίων και διάφορες άλλες τεχνικές. Ενώ οι προσεγγίσεις, αυτές, επιδεικνύουν απλότητα στη χρήση και προκαλούν μειωμένο προβληματισμό όσον αφορά ζητήματα βιοασφάλειας, υστερούν στην απόδοση της γονιδιακής μεταφοράς. Συγκεκριμένα, τα επίπεδα γονιδιακής έκφρασης παρουσιάζονται χαμηλότερα σε σύγκριση με αυτά των ιικών συστημάτων μεταφοράς, ενώ η έκφραση είναι παροδική.
Σημαντικό είναι να διευκρινιστεί ότι η μεταφορά των γονιδίων δύναται να πραγματοποιηθεί είτε εφόσον έχει προηγηθεί απομάκρυνση των κύτταρων από το σώμα του ασθενούς, όπου μετά τη μεταφορά θα ακολουθήσει μεταμόσχευση των εμπλουτισμένων με τα θεραπευτικά γονίδια κυττάρων και πάλι πίσω στον ασθενή ( ex vivo γονιδιακή θεραπεία), είτε χωρίς την απομόνωση των κυττάρων, αλλά απευθείας στα κύτταρα του σώματος του ασθενούς (in vivo γονιδιακή θεραπεία).
Ποιοι ιοί μπορούν να χρησιμοποιηθούν ως φορείς;
Ως οχήματα μεταφοράς γονιδίων έχουν χρησιμοποιηθεί τόσο ιοί που έχουν DNA, όσο και ιοί που έχουν RNA ως γενετικό υλικό (είτε μονόκλωνο είτε δίκλωνο).
Σε ένα μεγάλο αριθμό μελετών παρατηρείται η χρήση ρετροϊών ως μέσο μεταφοράς. Οι ρετροϊοί έχουν RNA ως γενετικό υλικό και μπορούν να ενσωματώσουν μέχρι και 8 kb ξένου γενετικού υλικού. Αφού ενσωματωθούν τα επιθυμητά γονίδια στον ιό και εφόσον ο ιός αδρανοποιηθεί, το RNA του μεταφέρεται στο εσωτερικό των ανθρώπινων κυττάρων όπου λαμβάνει χώρα η αντίστροφη μεταγραφή, δηλαδή η μετατροπή του RNA σε DNA. Έπειτα ακολουθεί ενσωμάτωση στο γονιδίωμα του κυττάρου και μακροπρόθεσμη έκφραση των γονιδίων με απώτερο σκοπό την πλήρη ή μερική αναστροφή των συμπτωμάτων της γενετικής ασθένειας. Η ενσωμάτωση των ρετροϊών στο ανθρώπινο γονιδίωμα γίνεται με τυχαίο τρόπο, γεγονός που σε ορισμένες περιπτώσεις έχει οδηγήσει σε φαινόμενα τοξικότητας. Ως εκ τούτου έχουν γίνει προσπάθειες ανάπτυξης ασφαλέστερων φορέων, των οποίων η ενσωμάτωση είναι πιο στοχευμένη.
Ελάττωση στη χρήση των ρετροϊών παρατηρήθηκε όταν ανακαλύφθηκαν οι λεντοϊοί ως δυνητικοί φορείς των θεραπευτικών γονιδίων. Οι λεντοϊοί είναι ρετροϊοί με δυνατότητα ενσωμάτωσης μεγάλων κομματιών γενετικού υλικού και παρουσιάζουν πιο ευνοϊκό προφίλ ενσωμάτωσης. Οι λεντοϊοί, σε αντίθεση με άλλους ιούς, προσβάλλουν, πέρα από διαιρούμενα, και μη διαιρούμενα κύτταρα, ενώ τείνουν να ενσωματώνονται σε κωδικές περιοχές του ανθρώπινου γονιδιώματος και όχι σε ρυθμιστικές, με αποτέλεσμα μειωμένη πιθανότητα τοξικότητας.
Οι αδενοϊοί αποτελούν τους πιο ευρέως χρησιμοποιούμενους φορείς. Περιέχουν δίκλωνο DNA και έχουν τη δυνατότητα ενσωμάτωσης μέχρι 7,5 kb γενετικού υλικού. Οι αδενοϊοί παρουσιάζουν υψηλή απόδοση όσον αφορά τη μεταγωγή, υψηλά επίπεδα γονιδιακής έκφρασης (παροδικής ωστόσο) και έχουν την ικανότητα μόλυνσης μη διαιρούμενων κυττάρων. Οι αρχικοί φορείς που χρησιμοποιήθηκαν προκαλούσαν σφοδρές ανοσολογικές αντιδράσεις, ωστόσο ύστερα από γενετικές τροποποιήσεις επιτεύχθηκε μειωμένη ανοσογονικότητα.
Ένας συγγενικός ιός, ο αδενοσχετιζόμενος ιός (AAV), χρησιμοποιείται επίσης συχνά σε μελέτες γονιδιακής θεραπείας. Ο ιός, αυτός, αποτελείται από μικρό μονόκλωνο RNA, παρουσιάζει χαμηλή παθογονικότητα και τοξικότητα και το γενετικό του υλικό δεν ενσωματώνεται στο γονιδίωμα του ανθρώπινου κυττάρου, αλλά σχηματίζει κυκλικό επίσωμα. Στην περίπτωση που χρησιμοποιείται ο AAV ως φορέας κρίνεται απαραίτητη η εφαρμογή της γονιδιακής θεραπείας επαναλαμβανόμενα.
Άλλοι ιοί που έχουν χρησιμοποιηθεί ως φορείς είναι φλαβοϊοί, ο ιός της ευλογιάς, ο ιός της δαμαλίτιδας και όχι μόνο. Αυτό που πρέπει να τονιστεί είναι πως δεν υπάρχει ένας ιός κατάλληλος για όλες τις περιπτώσεις. Η επιλογή του ιού εξαρτάται από το επιθυμητό επίπεδο έκφρασης του θεραπευτικού παράγοντα, την επιθυμητή διάρκεια, καθώς και τις προσωπικές προτιμήσεις του εκάστοτε ερευνητή/γιατρού.



Εικόνα 1: Ιικοί φορείς που έχουν χρησιμοποιηθεί για τη μεταφορά θεραπευτικών γονιδίων.
Ποιες ασθένειες αποτελούν στόχοι της γονιδιακής θεραπείας;
Απαραίτητη προϋπόθεση για να εφαρμοστεί η γονιδιακή θεραπεία είναι να έχει ταυτοποιηθεί το γονίδιο ή τα γονίδια που είναι υπεύθυνα για την εκάστοτε νόσο, αλλά και να έχουν κλωνοποιηθεί. Καίριας σημασίας είναι, επίσης, η εύκολη προσβασιμότητα των κυττάρων.
Παρόλο που οι αρχικές μελέτες ήταν περιορισμένες σε μονογονιδιακές ασθένειες, μεταγενέστερα παρατηρήθηκε μια διεύρυνση του φάσματος των γενετικών ασθενειών που αποτέλεσαν στόχοι της γονιδιακής θεραπείας. Όπως φαίνεται και στην εικόνα 2, ο καρκίνος αποτελεί τον κυριότερο στόχο της γονιδιακής θεραπείας. Στη συνέχεια ακολουθούν με χαμηλότερα ποσοστά μονογονιδιακές ασθένειες, λοιμώδεις ασθένειες, καρδιαγγειακές νόσοι και διάφοροι άλλοι τύποι ασθενειών.



Εικόνα 2: Τύποι ασθενειών που αποτέλεσαν στόχοι κλινικών δοκιμών γονιδιακής θεραπείας.
Ποιες προκλήσεις προέκυψαν κατά την εφαρμογή της γονιδιακής θεραπείας;
Μπορεί η γονιδιακή θεραπεία να φαντάζει στο μυαλό μας πανάκεια για την αντιμετώπιση της πλειοψηφίας των ανθρώπινων ασθενειών, ωστόσο δεν είναι λίγες οι φορές που αμφισβητήθηκε η αποτελεσματικότητα και η ασφάλεια αυτού του είδους θεραπείας.
Έπειτα από την πρώτη επιτυχημένη κλινική δοκιμή γονιδιακής θεραπείας το 1990, η οποία αφορούσε τη θεραπεία της βαριάς συνδυασμένης ανοσοανεπάρκειας (SCID), ακολούθησαν χιλιάδες ακόμα δοκιμές γονιδιακής θεραπείας μέσα στη δεκαετία του 90. Πολλές από αυτές τις δοκιμές κατέληξαν να είναι ανεπιτυχείς λόγω της υπέρμετρης αισιοδοξίας των ερευνητών, η οποία κρίθηκε αδικαιολόγητη σύμφωνα με τα Εθνικά Ινστιτούτα Υγείας (NIH) δεδομένης της έλλειψης βασικών γνώσεων που αφορούσαν τους ιούς , τα κύτταρα, τους ιστούς αλλά και τις διάφορες γενετικές ασθένειες.
Η μεταφορά των γονιδίων φάνηκε από τις αρχικές, ακόμα, μελέτες, ότι θα είναι η Αχίλλειος πτέρνα της γονιδιακής θεραπείας. Μεγάλος αριθμός επιπλοκών παρουσιάστηκε κατά τη προσπάθεια χρήσης ιικών φορέων για τη μεταφορά των γονιδίων. Οι επιπλοκές αφορούσαν την εμφάνιση ανεπιθύμητων ανοσολογικών αντιδράσεων, όπως στην περίπτωση του Jesse Gelsinger, ο οποίος κατέληξε λόγω έντονων ανοσολογικών αντιδράσεων κατά την προσπάθεια αντιμετώπισης της ανεπάρκειας της τρανσκαρβαμυλάσης της ορνιθίνης (OTC) ,από την οποία έπασχε, με τη βοήθεια της γονιδιακής θεραπείας. Εκτός από τις ανοσολογικές αντιδράσεις, σημαντικό πρόβλημα αποτέλεσε και η πιθανή τοξικότητα των ιικών φορέων.
Ύστερα από εντατική έρευνα και προσπάθειες για ανάπτυξη αξιόπιστων φορέων ακολούθησε μια δεύτερη γενιά πειραμάτων στις αρχές του 2000. Ενώ επιτυχημένες κλινικές δοκιμές έδωσαν σημάδια σημαντικού κλινικού οφέλους της γονιδιακής θεραπείας, τροχοπέδη στη ραγδαία πρόοδο και στην καθιέρωση της εφαρμογής της γονιδιακής θεραπείας αποτέλεσαν και πάλι η ανοσογονικότητα και η τοξικότητα των φορέων, οι οποίες επιβράδυναν την εξέλιξη της γονιδιακής θεραπείας.
Τα τελευταία 10 χρόνια οι διεξοδικές μελέτες για την κατανόηση του μηχανισμού της γονιδιακής θεραπείας, οι τροποποιήσεις που σχετίζονται με την ασφάλεια αυτού του είδους θεραπείας, καθώς και οι προσπάθειες για πιο αποδοτική μεταφορά και ενσωμάτωση των θεραπευτικών γονιδίων οδήγησαν σε επιτυχημένες εφαρμογές της θεραπείας που συνέβαλαν στην ουσιαστική κλινική πρόοδο της. Ενθαρρυντικά φαίνονται τα αποτελέσματα που αφορούν πολλαπλές ασθένειες, συμπεριλαμβανομένης της β-θαλασσαιμίας, της μεταχρωματικής λευκοδυστροφίας, του συνδρόμου Wiskott–Aldrich και της συγγενούς αμαύρωσης Leber. Ανάμεσα σε πολλά αξιοσημείωτα αποτελέσματα μελετών ορόσημο αποτελεί το Glybera, το πρώτο εμπορικά διαθέσιμο προϊόν γονιδιακής θεραπείας. Το Glybera εγκρίθηκε το 2012 από την Ευρωπαϊκή Επιτροπή Φαρμάκων και στοχεύει στη θεραπεία της ανεπάρκειας της λιποπρωτεϊνικής λιπάσης (LPLD). Επίσης, αρκετά γονιδιακά προϊόντα έχουν εγκριθεί από τον Οργανισμό Τροφίμων και Φαρμάκων (FDA). Ένα από αυτά είναι η γονιδιακή θεραπεία Luxturna που στοχεύει στη θεραπεία ασθενών που πάσχουν από κληρονομική απώλεια όρασης που μπορεί να οδηγήσει σε τύφλωση, αλλά και το προϊόν Zolgensma για τη θεραπεία παιδιών σε ηλικία μικρότερη των 2 χρόνων που πάσχουν από Νωτιαία Μυϊκή Ατροφία (SMA).



Εικόνα 3: Χρονοδιάγραμμα κλινικών δοκιμών γονιδιακής θεραπείας που βασίστηκαν στη χρήση αιμοποιητικών βλαστικών κυττάρων.
Ποια ηθικά ζητήματα σχετίζονται με τη γονιδιακή θεραπεία;
Παράλληλα με την πρόοδο της γονιδιακής θεραπείας έχουν σημειωθεί έντονες αντιπαραθέσεις που άπτονται ηθικών ζητημάτων . Ένα ζήτημα που εγείρει αντιδράσεις είναι η γονιδιακή θεραπεία γαμετικής σειράς, η οποία επηρεάζει όχι μόνο το θεραπευόμενο άτομο, αλλά και τους απογόνους του, οι οποίοι προφανώς δεν έχουν δώσει τη συγκατάθεσή τους. Επίσης, κοινωνική ανησυχία προκαλεί το γεγονός ότι η ενισχυτική γονιδιακή θεραπεία, η οποία στοχεύει στην ενίσχυση κάποιων επιθυμητών χαρακτηριστικών και όχι στη θεραπεία κάποιας ασθένειας, θα μπορούσε να είναι ένα πιθανό επόμενο βήμα εξέλιξης της γονιδιακής θεραπείας. Τέλος, πολυάριθμες συζητήσεις αφορούν το κόστος της γονιδιακής θεραπείας, την ασφαλιστική κάλυψη αλλά και το αν συντρέχει λόγος να διενεργηθεί η γονιδιακή θεραπεία σε όλες τις περιπτώσεις.
Φτάνοντας στο τέλος, η γονιδιακή θεραπεία έχει σημειώσει αλματώδη πρόοδο τα τελευταία χρόνια και φαίνεται να αποτελεί ένα ρηξικέλευθο και ενθαρρυντικό βήμα για την αντιμετώπιση πληθώρας γενετικών ασθενειών. Ωστόσο ο δρόμος για την ενσωμάτωση αυτού του είδους θεραπείας στο ¨οπλοστάσιο¨ της συμβατικής Ιατρικής και στις κλινικές εφαρμογές ρουτίνας είναι μακρύς και δύσβατος. Χρειάζονται συνεχείς μελέτες και κλινικές δοκιμές για την εξασφάλιση ζητημάτων αποτελεσματικότητας και ασφάλειας, ενώ επιτακτική είναι η ανάγκη για τη σύνταξη νομικών διατάξεων και κανόνων δεοντολογίας από διεθνείς επιτροπές με γνώμονα το ευρύτερο κοινωνικό συμφέρον.
Βιβλιογραφικές αναφορές
- Samantha L. Ginn, Anais K. Anaya, Ian E. Alexander, Michael Edelstein, Mohammad R. Abedi, ¨Gene therapy clinical trials worldwide to 2017: An update¨, J Gene Med 20, 3015 (2018)
- Cynthia E. Dunbar, Katherine A. High, J. Keith Joung, Donald B. Kohn, Keiya Ozawa, Michel Sadelain, ¨ Gene therapy comes of age¨, Science 359, 175 (2018)
- Kerstin B. Kaufmann, Hildegard Büning, Anne Galy, Axel Schambach, Manuel Grez,¨Gene therapy on the move ¨, EMBO Mol Med 5, 1642-1661 (2013)
- Kenneth Lundstrom, ¨Viral Vectors in Gene Therapy¨, Diseases 6, 42 (2018)
- William S. Klug, Michael R. Cummings, Charlotte A. Spencer, Michael A. Palladino, Darrell Killian, ¨Βασικές αρχές Γενετικής¨, Ακαδημαϊκές Εκδόσεις, 925-943, 2019
- Peter J. Russell, ¨iGenetics.Μια Μεντελική προσέγγιση¨, Ακαδημαϊκές Εκδόσεις, 2009-2013
- https://www.fda.gov/consumers/consumer-updates/what-gene-therapy-how-does-it-work
- https://www.fda.gov/news-events/press-announcements/fda-approves-novel-gene-therapy-treat-patients-rare-form-inherited-vision-loss
- https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease
Εικόνες
Εικόνα 1: Samantha L. Ginn, Anais K. Anaya, Ian E. Alexander, Michael Edelstein, Mohammad R. Abedi, ¨Gene therapy clinical trials worldwide to 2017: An update¨, J Gene Med 20, 3015 (2018)
Εικόνα 2: Samantha L. Ginn, Anais K. Anaya, Ian E. Alexander, Michael Edelstein, Mohammad R. Abedi, ¨Gene therapy clinical trials worldwide to 2017: An update¨, J Gene Med 20, 3015 (2018)
Εικόνα 3: Kerstin B. Kaufmann, Hildegard Büning, Anne Galy, Axel Schambach, Manuel Grez, ¨Gene therapy on the move ¨, EMBO Mol Med 5, 1642-1661 (2013)
Truemed-ForLivingMore
Κοινοποιήστε
ΔΙΑΒΑΣΤΕ ΕΠΙΣΗΣ
© 2019 TrueMed Media. All rights reserved. Our website services, content, and products are for informational purposes only. TrueMed Media does not provide medical advice, diagnosis, or treatment.

Το μέλος αυτό έχει μπει στην ομάδα της TrueMed, αλλά ακόμα δεν εχει συνεισφέρει κάποιο άρθρο στην σελίδα μας.